
집에서 요리하는 것이 건강을 보호하는 데 도움이 될 수 있는 것처럼 보이지만, 사실, 우리의 부엌에서도 눈에 보이지 않는 "주범"이 있다. 주된 이유는 사람들의 요리 습관에 있다. 예상치 못한 사실: 볶는 것이 튀기는 것보다 더 해롭다. 튀김은 인기 있는 요리 방법이고 많은 가족으로부터 사랑 받고 있지만, 건강에 나쁜 영향을 많이 주기 때문에 그것을 제한하는 것이 권장된다. 하지만, 실험을 한 후에, 전문가들은 볶음 요리가 튀김보다 훨씬 더 해롭고 더 많은 발암물질을 만든다는 것을 발견했다! 베이징 위성TV는 중일우호병원 흉부외과 류득나 원장을 초청했다. 프로그램에서, 그들은 감자튀김을 만들었고 pm2.5 (인간의 건강에 큰 해를 끼치는 먼지 중 하나) 검출기로 그것들을 시험했다. 오일 팬 근처의 pm2.5 값이 320에 도달했다는 것을 확인했다! 그 후, 그 프로그램은 야채를 즉석에서 튀기기 위해 소량의 기름을 계속해서 사용했다. 그들은 또한 pm2.5 검출기로 테스트했고 그 결과는 600에서 나왔고 그것은 한동안 검출기의 최대 검출값을 초과했다! 오류를 없애기 위해 류 원장과 진행자는 같은 기름을 두부 튀김에 사용했지만 pm2.5 검출기는 훨씬 높았다.
보건부는 아스트라제네카 백신 2회 접종 주사 기간 단축을 지방과 시가 스스로 결정하는데 동의했지만, 그것은 제조사인 WHO의 권고에 근거해야 한다. 20일 오후 보건부믐 아스트라제네카 주사 2회 간격 단축에 대한 롱안과 호찌민시의 제안과 관련, 지방 보건부와 중앙자치도시에 공식 서한을 보냈다. 도쑤안투옌 보건부 차관이 서명한 문서에는 보건부가 세계보건기구(WHO)의 권고와 제조사, 보건부의 예방접종 일정, 2차 접종 시 보호효과 등을 근거로 명시돼 있다. 백신 2회 접종 사이의 최소 시간은 제조사의 지침을 준수해야 하며 전염병 예방과 통제를 충족하면서 전염병 상황에 적합해야 한다. 구체적으로 보건부는 백신 제조업체 아스트라제네카의 사용지침에 따르면 첫 주사 후 22일부터 백신 보호효율이 69.2%에 이른다고 밝혔다. 두 번째 주사 후 6주 이내에 효과는 55.1%에 달했다. 6-8주 후에는 비율이 59.7%, 12주 후에는 80%에 달한다. 제조업체의 지침에 따라 2차 주사는 1차 주사 후 약 4-12주 후에 진행되야 한다. 세계보건기구(WHO)는 이 두 접종 주사 사이에 8주에서 12주의 간격을 둘 것을 권고한다. 보건부는 아스트라제네카 백신 1회 접종자(

나노코박스는 또한 약품 및 의약품의 유통 등록을 위해 자문위원회의 승인을 받아야 한다. 그리고 보건부에 긴급 면허를 제안하기 전에 보호의 효과를 평가해야 한다. 8월 19일 유사시 보건부의 코비드-19 백신 유통 등록 지침에는 국내에서 생산된 백신이 안전을 위해 임상 3상의 중간 평가 결과를 가질 필요가 있다고 명시되어 있으며, 예방 효과는 이미 이용 가능한 면역성 데이터에 기초하고 있다. 보건부에 긴급 허가를 요청하기 전에 면허 신청서는 국가생명공학연구윤리위원회(윤리위원회라 함)와 의약품 및 의약품 유통등록증 발급을 위한 자문위원회(약칭 자문위원회)의 승인을 받아야 한다. 특히 나노코박스의 경우 보건부의 지시에 따른 기록 요건을 충족시켰다. 현재 이 백신은 임상 3상 중간보고에서 안전성, 면역성, 보호효과 등을 평가받고 있다. 8월 6일, 제조사는 나노코박스를 주입한 그룹과 코비드-19로부터 회복된 그룹의 면역유전성 결과를 비교하면서 호치민 파스퇴르 연구소의 2단계 임상 연구 결과를 바탕으로 백신의 보호 효과를 약 90%로 추정했다. 따라서, 9월 18일, 윤리 위원회는 3단계 중간 보고서를 평가하기 위한 회의를 열었다. 안전성 및 면역성에 대해 백신을 검

쿠바 산 압달라 코비드-19 백신은 9월 18일 보건부에 의해 코비드-19 전염병의 예방과 통제에 긴급한 필요성에 대한 조건부 승인을 받았다. 9월 20일, 정부는 쿠바 유전공학 및 생명공학 센터에서 생산한 압달라 코비드-19 백신 1천만 도스의 구매에 관한 결의안을 발표했다. 이 소식통은 총리가 입찰법 제26조에 명시된 특별한 경우 계약자 선정 형식을 적용할 수 있도록 허용하고 있다고 말했다. 특정 조건에는 백신이나 백신 사용과 관련하여 발생하는 클레임에 대한 거부권의 수용, 계약서에 명시되지 않은 물품의 납품을 수락, 쿠바 유전공학 및 생명공학 센터의 납품이 더딘 경우 1천만도스의 백신을 계속 공급받는 것이 포함된다. 또 쿠바 유전공학생명공학센터는 계약 이행에 대한 사전 보증이나 보증을 할 필요가 없다. 정부는 보건부에 압달라 코비드-19 백신 구매를 가장 빠른 방법으로 긴급히 조직하여 품질, 진행 및 효율성을 보장하도록 지시했다. 압달라 백신은 9월 18일 코비드-19 전염병의 예방과 통제에 긴급한 필요성을 위해 보건부에 의해 조건부 승인되었다. 베트남에서는 백신 및 의료생물의 연구생산센터(POLYVAC)가 이 백신의 승인을 요청한 곳이다. 압달라 백신
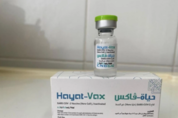
최근, 베트남 의약청은 비메디멕스 메디컬 및 제약 합작 주식회사가 3천만 도스의 하얏트-백스 백신을 수입하는 것을 허용하는데 동의했다. 이것은 베트남에서 코비드-19의 예방과 통제에 긴급한 필요를 위해 보건부가 허가한 7번째 백신이다. 9월 16일, 베트남 의약국(보건부)은 아랍에미리트에서 만들어진 3천만 도스의 하얏트-백스 백신을 비메디멕스 메디컬 및 제약 합작 주식회사에 수입 허가를 내렸다고 보도했다. 이전에, 하얏트-백스라는 이름의 코비드-19 백신은 9월 10일 코비드-19 전염병의 예방과 통제에 긴급한 필요성에 대해 보건부에 의해 조건부 승인되었다. 이에 따라 하얏트-백스 백신은 중국 국립바이오텍그룹(CNBG)의 베이징생산물연구소에서 반제품으로 생산된다. 이 백신은 1차 및 2차 포장으로 포장되어 아랍에미리트 줄파르(걸프 제약 산업)로 배송된다. 베트남에서는 비메디멕스 메디컬·제약합동주식회사가 이 백신을 승인해 줄 것을 제안했다. 하얏트-백스 백신은 매 0.5ml 용량마다 6.5 단위의 사스-CoV-2 항원(베로 세포)이 비활성화되어 주사 가능 서스펜션 형태로 준비된다. 이 백신은 0.5ml의 1회 복용량과 0.5ml의 2회 복용량을 각각 담은 1회

국립생물의학연구윤리위원회는 나노코박스의 3단계 중간 임상실험 보고서를 승인했다. 국립생물의학연구윤리위의회는 이날 오후 5시45분 나노코박스와 함께 3상 중간 임상시험 보고서를 승인해 국내 백신에 대한 허가 검토의 길을 열었다. 한 소삭통은 코비드-19 백신 개발에 앞장서고 있는 민간 기업인 나노젠이고 다른 하나는 보건부의 소식통이라고 오늘 저녁 법률신문에 말했다. 또한, 국립생물의학윤리연구위원회 위원장 – 교수 쯔엉비엣둥 또한 이 정보를 확인했다. 일전에 군의학의 민족 윤리위원회가 소집돼 단계를 평가한 뒤 나노젠이 군의료관아카데미 통해 지원서를 제출했다. 국가윤리위원회는 오늘 만나 하루 이상 조사했고 만족스럽다고 평가했다고 비엣둥 교수는 법률신문에 응답했다. 군의관 아카데미는 보건부와 나노젠이 3b단계 자원봉사자 1만2000명에 달하는 나노코박스 실험 결과에 대한 상당한 가치가 있는 초기 데이터를 포함한 3상 임상시험 중간보고서를 제출하기로 합의한 나노코백신의 임상시험을 조직한 중심기관이다. 지난 8월 22일 국가 윤리위원회는 중간보고서 3단계에 대해 자원봉사자 1000명을 대상으로 8월 18일까지 수집한 자료로만 평가했으며, 이번 회의 결과 나노코박스 백신

9월 19일 오전 국가생물의학연구윤리위원회는 코비드-19 나노코박스 백신이 "안전 요건을 충족하며, 보호 효과를 평가할 데이터가 없다"고 통보했다. 보건부는 19일 오전 윤리위원회 중기 임상3상 결과를 검토하기 위한 회의 결과를 통보했다. 이에 따라 윤리위원회는 현재까지 보고된 3상 임상시험 결과 자료를 토대로 나노코박스 백신이 단기 안전요건을 충족한다고 결론 내렸다. 안전, 면역성, 보존 효능 백신 보호 등 3개 사안을 확정했다. 이는 9월 18일 오후 윤리위원회 나노코백신 2차 회의에서 나온 공식 결론이다. 이와 함께 윤리위원회는 지금까지 3상 임상시험 중간 결과를 토대로 나노코박스 백신을 면역 물질로 평가했다. 그러나 백신의 보호 효능에 대해서는 현재 연구에서 코비드-19 사례의 수를 직접 평가할 데이터가 없다. 이사회는 연구부서가 승인된 프로토콜에 따라 보호효과 평가를 계속 수행할 것을 권고했다. *나노코박스 백신 윤리위원회는 이 같은 결론과 평가를 통해 임상시험 연구결과(중기 결과평가 3단계 시점까지)를 승인하고 상임자문회의에 회부해 검토하도록 했다. 윤리위원회는 나노젠제약 생명공학공동주식회사와 백신연구팀이 회의 결과에 따라 보고서를 작성하고 202

호찌민시 보건부는 1회 복용량의 백신을 주입하는 사람에게 코비드-19 그린 카드를 발급하는 계획을 포함하여 코비드 그린 카드에 대한 두 가지 조건을 제안했다. 9월 18일자 시 보건부가 코비드-19 예방 및 통제 운영위원회에 제출한 문서에 따르면 코비드 그린 카드 적용에 관한 것이다. 보건부는 코비드 그린 카드에 대한 두 가지 조건을 제안한다. 1. 최소 1회 접종 (2회 접종이 필요한 백신의 종류)을 하고 접종한 기간이 최소 2주 이상 지난 자 2. 코비드-19에 감염되었으며 병동, 코뮌 및 동네의 질병 예방 및 통제를 위한 운영위원회가 발급한 격리 기간 완료 인증서를 보유한자 전문 및 의료용 코비드 그린카드는 사스-CoV-2 바이러스로부터 신체를 보호하는 면역력을 가졌다는 인식의 한 형태로 간주된다. *시민은 전자건강장부 애플리케이션에 2회분의 백신을 받았다는 녹색 증명서를 받는다. 그린 카드 소지자는 코비드-19에 걸릴 위험이 낮거나 병이 난 경우 중증 질환의 위험이 줄어든다. 하지만, 그린카드가 있다고 해서 한 개인이 다른 사람들을 감염시키지 않는다는 뜻은 아니다. 당국은 코비드-19 그린 카드 소지자는 보건부 규정에 따라 5K를 준수해야 하며 주기적

▶9월 18일: 총 9,373명 발생, 호찌민시 4,237명, 빈증 2,877명 발생 9월 18일 저녁 발표한 감염자 9,373명 중 33개 성에서 9,360명이 발생해 어제보다 2,146명 줄었고, 14,903명이 회복했고, 220명이 사망했다. 최근 24시간 동안 지역사회 발생건수는 4,827건(1,829건 감소)으로 격리 또는 봉쇄지역에서 4,533건(317건 감소)이 적발되었다. 호찌민시 감염자수는 1,735명 감소, 빈증은 1,136명 감소, 동나이는 594명 증가했고, 롱안은 37명 감소했고, 띠엔장은 79명 증가했다. 지난 7일 동안 기록된 국내 평균 신규 감염자 수는 10,723명이다. 오늘 사망자는 220명이다. 호찌민시 165명, 빈증 39명, 끼엔장 7명, 따이닌 3명, 동탑 2명, 빈투언 1명, 탄호아 1명, 꽝아이 1명, 하노이 1명이다. 지난 7일 동안 기록된 평균 사망 건수는 250건이다. 지금까지 베트남의 총 사망자 수는 1만6857명으로 전체 사망자 수의 2.5%, 세계 사망률(2.1%포인트)보다 0.4%포인트 높다. *가장 높은 감염자을 기록한 5개 지방(모두 남부 지방이며, 호찌민시 주변 성이다) 9월 18일 9,360명 감
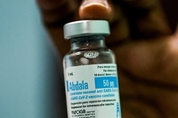
0.5ml의 압달라 백신은 근육 내 주입을 위한 중단제로 준비된 사스-CoV-2 바이러스의 수용체 결합 부위(RBG)를 함유한 50mcg의 재조합 단백질 백신을 포함하고 있다. 보건부는 2021년 9월 17일자 4471/QD-BYT 결정을 발표했는데, 이는 코비드-19 질병 예방 및 통제의 긴급한 요구에 대한 압달라 백신의 조건부 승인에 관한 것이다. *압달라 백신 압달라 백신은 정부 2012년 5월 8일자 약사법 제54조 2017년/ND-CP 제67조의 규정에 따라 승인되었다. 승인 문서에 따르면 이 백신은 AICA Raberaties Company, BBU(Base Business Unit) AICA-쿠바에서 제조된다. 그리고 반제품으로 수출되어 쿠바 유전공학 및 생명공학 대학(CIGB)의 레벨 2에서 포장되었다. 베트남에서는 백신 및 의료생물의 연구생산센터(POLYVAC)가 이 백신의 승인을 요청했다. 보건부는 또한 코비드-19 전염병의 예방과 통제에 있어 긴급한 필요성에 대한 압달라의 승인에 첨부된 조건들을 명시하고 있다. 각 백신 투여량은 근육 내 주입을 위한 중단제로 준비된 사스-CoV-2 바이러스의 수용체 결합 부위(RBG)를 함유한 재조합 단백